小学生でも分かるエントロピーの話
2016/5: 初版
2017/2: 改訂
2018/2: 追記
2018/7:誤記訂正
2018/12:チャート追加
2019/11:誤記訂正
2021/8:追記
2017/2: 改訂
2018/2: 追記
2018/7:誤記訂正
2018/12:チャート追加
2019/11:誤記訂正
2021/8:追記
目次
1. はじめに
最近まれに、”エントロピー”という聞き慣れない言葉を耳にしますが、一体何なのでしょうか?
ネットで良く見られるエントロピーの概念図
ネットで調べるといくらでも説明文が出てきますが、余りに難解でいくら読んでも結局良く分からないままではないでしょうか?
実際グーグルで検索すると、以下の説明文が真っ先に表示されますが、これを読んで分かる方は殆どいないでしょう。
原子的排列および運動状態の混沌(こんとん)性・不規則性の程度を表す量。
▷ 熱力学や情報理論などで使う
▷ 熱力学や情報理論などで使う
と言う訳で、ここでは小学生にも分かる様に”エントロピー”についてご説明したいと思います。
ただし、折角最後までお読み頂いても、もしかしたら予想外の結末になるかもしれない事を、事前にお断りしておきます。
2. 新たな結論
2017/1: 追記
従来本書の結論は、本文末尾に”エントロピーは日常生活には全く役立たたない”と記載して締めくくっていたのですが、これではどうみても不十分でしたし、不親切でした。
なぜならば、これではエントロピーとは何かとの説明にはなっていなかったからです。
実際日常生活には全く役に立たないとは言え、下の例の様にまるで流行(はやり)の様に使われていると、エントロピーとはどんなに奥深くて画期的な概念かと思うのも、無理からぬ事と言えます。
この部屋は散らかっているのでエントロピーが高い。
コーヒーにミルクを入れてかき混ぜたらエントロピーが高くなった。
経済系は生態系から資源、エネルギーを採取し、そして生態系へエントロピーを排出する。
環境問題において重要なのは、エントロピーを増加させない事だ。
廃棄物の処分が出来なくなった時点、すなわちエントロピーが最大となったところで、経済成長は止まらざるを得なくなる。
情報の価値を失うという事は、情報エントロピーを受け取るという事である。
このためには、エントロピーをもっと端的に分かり易く言えないかと思っていたのですが、この度ようやく思い付きました。
それがこれです。
”エントロピー”とは”ゴミ”の事である。
エントロピーというかなりアカデミック(高尚)な単語を、一気に落しめてしまう様に取られるかもしれませんが、これはかなり近い言葉ではないでしょうか?
これに置き換えれば、先ほどの意味不明な文章たちも、立ちどころに分かり易い文章になります。
この部屋は散らかっているのでゴミが多い。
コーヒーにミルクを入れてかき混ぜたらゴミの様になった。
経済系は生態系から資源、エネルギーを採取し、そして生態系へゴミを排出する。
環境問題において重要なのは、ゴミを増加させない事だ。
廃棄物の処分が出来なくなった時点、すなわちゴミが最大となったところで、経済成長は止まらざるを得なくなる。
情報の価値を失うという事は、情報ゴミを受け取るという事である。
いかがでしょうか?
ゴミとは、もうこれ以上使えなくて、捨てるしかないものです。
それに対してエントロピーとは、使い切ってもとに戻らない度合いを示すのですが、日常的に使われているエントロピーとは、ゴミとほぼ同意語で使われていると思って大きな間違いではないでしょう。
ですので、もしまたどこかでエントロピーという言葉を耳にしたら、またゴミが増え続ける話を格好を付けて話しているのだなと思えば良いのです。
もしここまでお読み頂いて、エントロピーを知った気分になった方は、この先をお読み頂く必要は一切ありません。
この先に書かれているのは、いかにエントロピーが役に立たないかを延々と述べていますので、それでも良い方のみお読み頂ければと思います。
3. エントロピーとは
それでは、エントロピーについてもう少し詳しく知りたい方のために、先に要点を述べておきましょう。
本来のエントロピーとは、熱力学における方向性のある現象の度合いを、数値化したものです。
この方向性のある現象とは、一方向には進むものの、逆方向には戻らないという事を指します。
この元に戻らない現象の事を、難しく”不可逆性”と呼びますので、これを使って書き直すと、以下の様になります。
本来のエントロピーとは、熱力学における不可逆性の度合いを、数値化したものです。
この方が多少日本語としては分かり易い気もするのですが、それでもまだ良く分からないと思いますので、これから順を追ってご説明したいと思います。
なおついでに言っておきますと、可逆性のある場合においてのみエントロピーはゼロとなり、マイナスになる事は決してありません。
4. 方向性のある現象
それでは次に、自然界における方向性のある現象をご説明したいと思います。
と言いながら、この事例は以下の様にそれこそ無数にあります。
①物体は上から下へ落ちたら元には戻らない。(覆水盆に返らず)
②全ての生物は歳をとる。
③インクを水に落とすと広がって元には戻らない。
④部屋はどんどん汚れていく。
⑤機械はいつか壊れる。
⑥情報は一度開示されると、どんどん価値が下がって陳腐化する。
⑦熱は温度の高い物から低い物に流れていく。
そしてエントロピーの概念を作るきっかけになったのが、⑦なのです。
その理由はワットが蒸気機関車を発明して以降、何とかもっと熱を有効利用して、効率の良い蒸気機関車や内燃エンジンを作ろうとして、熱力学に関する学問が進んでいったからに他なりません。

熱力学を開花させた蒸気機関車
ところで、”熱は温度の高い物から低い物に流れていく”と言っても、何の事か良く分からないのではないでしょうか?
実際、①~⑤は目に見えたり、良く体験する変化なのですが、熱だけは目に見えないので、どう流れているかピンとこないと思います。
ですが、次の様に話せば、分かって頂けるのではないでしょうか?
5. 熱は温度の高い物から低い物に流れていくとは
例えばここに、男性と女性がいたとします。
男性は、女性より少し体温が高いとします。(逆もあるでしょうが)
そこで、男性が女性の手を両手で握ったとします。
すると女性の手は暖まり、男性の手は僅かに温度が下がり、二人の手の温度が同じになるというのは誰でも想像できると思います。
ところが今度は逆に、男性の手を暖めるために、女性が男性の手を両手で握ったとします。
すると男性の手が暖まり、女性の手の温度が下がる、という事はないというのも容易に想像できると思います。
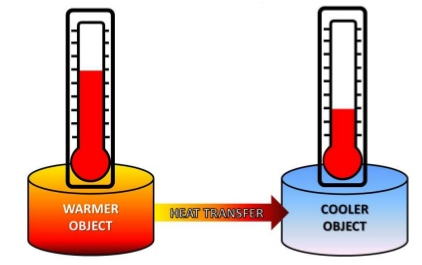
すなわち、熱は温度の高い方から低い方にしか流れず、温度の低い女性の手からは、温度の高い男性の手には流れないのです。

熱は温度の高い方から低い方にしか流れない
これで、熱は温度の高い物から低い物に流れていく、というのは理解していただけたでしょうか?
これを専門用語で、熱力学の第二法則と呼びます。
トースターはチンと鳴ってから1分待つ
2018/1: 追記
それではここで、本サイトお得意の脱線です。
貴方はオーブントースターを使って、パンを焼いているとします。

その場合、ヒータの出力を選択してタイマーをセットし、チンと鳴ったら正面扉を開けてパンを取り出すと思います。
ですが、そこでちょっと待って下さい。
なぜならば、そのチンと鳴った瞬間は、まだトースター内部の温度の方がパンの温度よりかなり高いのは間違いありません。
という事は、熱力学の第二法則によりトースターの熱はまだパンに伝わり続けているのです。
ではいつまでそれが続くのかですが、機内の温度とパンの温度が同じになるまで続くのです。
にも関わらずチンとなって即パンを取り出すのは、無駄に熱を捨てている事になります。
ですので、もし電気代を少しでも節約したいのでしたら、タイマーの時間をいつもより少し短か目にして、チンと鳴ってから1分程(もし数枚焼いた後であれば数分)待ちましょう。
そうすればトースターの熱を無駄なくパンに伝える事ができます。
明日の朝から、是非試してみて下さい。
ただし、電子レンジの場合は別です。
電子レンジの場合、熱(電磁波)が直接食べ物を暖めますので、チーンとなったら即取り出して暖かい内に頂きましょう。
さもないと、食べ物の熱がどんどん電子レンジの庫内に移ってしまいます。
貴方はオーブントースターを使って、パンを焼いているとします。

その場合、ヒータの出力を選択してタイマーをセットし、チンと鳴ったら正面扉を開けてパンを取り出すと思います。
ですが、そこでちょっと待って下さい。
なぜならば、そのチンと鳴った瞬間は、まだトースター内部の温度の方がパンの温度よりかなり高いのは間違いありません。
という事は、熱力学の第二法則によりトースターの熱はまだパンに伝わり続けているのです。
ではいつまでそれが続くのかですが、機内の温度とパンの温度が同じになるまで続くのです。
にも関わらずチンとなって即パンを取り出すのは、無駄に熱を捨てている事になります。
ですので、もし電気代を少しでも節約したいのでしたら、タイマーの時間をいつもより少し短か目にして、チンと鳴ってから1分程(もし数枚焼いた後であれば数分)待ちましょう。
そうすればトースターの熱を無駄なくパンに伝える事ができます。
明日の朝から、是非試してみて下さい。
2018/11:追記
ただし!ただし、電子レンジの場合は別です。
電子レンジの場合、熱(電磁波)が直接食べ物を暖めますので、チーンとなったら即取り出して暖かい内に頂きましょう。
さもないと、食べ物の熱がどんどん電子レンジの庫内に移ってしまいます。
6. 熱とは
話は前後しますが、それでは熱力学における熱とは何でしょう。
この定義はいくつかあるのですが、ここでは以下の様に決めたいと思います。
熱とは物体の温度を上げるエネルギーである。
ですので、手の温度を少しでも上げるものを熱と呼ぶ事で、前項の話も特に矛盾はないと思います。
またここでもう一つ重要な事は、物の温度を上げない限り、それを熱とは呼ばない事です。
ですので、例えばもしここに暖かい手があったとしても、それが何かに接触して相手の温度を上げない限り、熱とは呼ばないのです。
相手の温度を上げない限り、熱とは呼ばない
何故ならば、あらゆる物が熱を持っている事にすると、それを全部足せばとてつもないエネルギーになりますが、その物より温度の低い物がない限り熱の移動が無いからです。
少し奇妙な気がするかもしれませんが、熱力学における熱とはそんなものだと思ってしまいましょう。
2018/2: 下記追加
また熱についてもう一つ付け加えますと、熱(エネルギー)はプラスしか存在しないという事です。
言葉としては、暖かい手が冷たい手からマイナスの熱を受け取ったとも言えますが、実態としては熱はプラスだけで、マイナスの熱は存在しないのです。
日常生活では全く気にしなくて良いのですが、マイナスの熱とか、負のエネルギーとかいう言葉は、(空間や時間の歪みの説明でもしない限り)普段は使わない方が賢明です。
前段で、負のエントロピーは存在しないと言ったのは、これが理由です。
7. 熱量とは
エントロピーの話をする前に、もう一つお話しておく事があります。
それは、熱量です。
では熱量とは何かですが、読んで字のごとく熱の量を数値で表したものです。
ですので、先ほどお話した様に、暖かい手があるだけでは、熱が存在しないので、熱量もゼロなのです。
よく理科の問題で、水10gの温度を10℃上げるのに必要な熱量を求めよというのがありますが、水温10℃の水10gの熱量を求めよ、というのは見た事が無いのは、そういう理由からです。
余り重要な事ではありませんが、知らない人も多いので、覚えておいて損はありません。
まとめますと、熱量とは移動できる熱(エネルギー)の量を数値化したものです。
8. エンタルピーとは
2017/1: 追記
長々と熱と熱量に話をしてしまいましたが、実はとある下心があったのです。
突然ですが、エンタルピーという言葉を聞かれた事はありますでしょうか?
エントロピーではなく、エンタルピーです。
実は先ほどお話ししました熱量こそが、実はエンタルピーなのです。
だったら熱量と言えば良いだろうと思われるでしょう。
全く以てその通りなのですが、熱力学においてはこれまた格好を付けて、受け取った熱量の事をエンタルピーと呼ぶのです。
厳密に言えば、同じ気圧の下でという条件が付くのですが、熱の受け渡しをしている最中に山に登ったり下りたりしない(気圧が変わらない)限り、エンタルピーとは受け取った熱量(エネルギーの量)の事だと思って構いません。
9. エントロピー
お待たせしました。
それではいよいよエントロピーの話です。
エントロピーは、以下の簡単な式で求められます。
S(エントロピー)=Q(熱量)/T(絶対温度)
この式は、長年熱力学に関わった学者の皆さんが数々の実験を繰り返して、カルノーサイクルと呼ばれるの理想の熱機関の体系をまとめ上げた際に派生した式です。
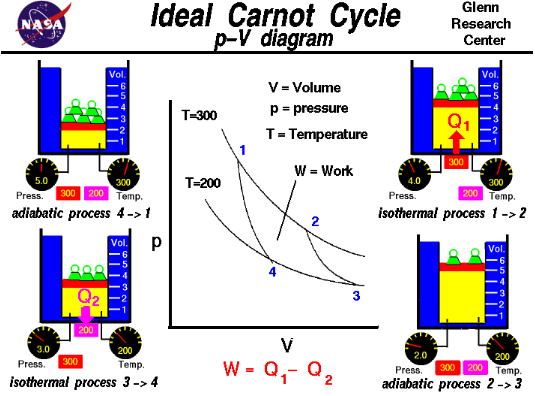
NASAが作成したカルノーサイクルの説明図
カルノーサイクルでは、熱を仕事に変える事もできますし、逆に仕事で熱を奪う事もできる現実には存在しない可逆性熱機関です。
これを利用して熱効率を調べていくと、至る所にQ/Tの式が出現し、更に現実の熱機関においては何か仕事をするたびにこのQ/Tが増えていくのに気が付きました。
正確には以下の通りですが、いつか大人になってから紐解いて下さい。
理想の熱効率=1-QL/QH=1-TL/TH
という事は、QL/QH=-TL/TH
という事は、QH/TH-QL/TL=0
だったら∫dQ/T=0だろう。
という事は、QL/QH=-TL/TH
という事は、QH/TH-QL/TL=0
だったら∫dQ/T=0だろう。
ならばこのQ/Tをエントロピーと名付けて、不可逆性の指標にしようと決めたという訳です。
ですので、最初にお伝えした以下も正確ではありません。
本来のエントロピーとは、熱力学における不可逆性の度合いを、数値化したものです。
もっと正確に言えば、以下の様になります。
本来のエントロピーとは、熱力学においてたまたま見つかった不可逆性の指標である。
そしてこの式から、以下の事が言えます。
熱の移動量が多ければ多いほど、不可逆性は高くなる。
ただし、それによって温度の変化量が大きければ不可逆性は低くなる。
故に、ほんの少しの熱で温度が跳ねあがる熱機関があれば可逆性に近付ける。
ただし、それによって温度の変化量が大きければ不可逆性は低くなる。
故に、ほんの少しの熱で温度が跳ねあがる熱機関があれば可逆性に近付ける。
これを図で表すと以下の様になります。
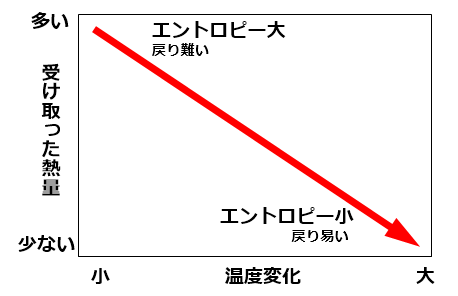
エントロピーのイメージ図(2018/12追加)
それが分かった所で、次にエントロピーが分かって日常生活にどんな良い事があるのか考えてみましょう。
と言っても、何も材料が無いと少々難しいので、実際にエントロピーを計算して、その値を見てから判断してみたいと思います。
ちなみに、既にお伝えしました様に可逆性熱機関のエントロピーはゼロで、不可逆性が高まるほどエントロピーの値は高くなります。
寒いとエンジンの出力はアップするのか?
2021/8: 追記
またまた脱線です。
巷では寒い方がクルマのエンジン出力はアップすると言われていますが、本当でしょうか?

寒いとエンジンの出力はアップするのか?
これを、以下にありますカルノーサイクルにおける理想気体の熱効率の式から求めてみます。
ここで最低温度を外気温度の30℃(絶対温度303度)、最高温度をエンジン内の2000℃(絶対温度2273度)とすると、熱効率は87%になります。
また最低温度を外気温度の0℃(絶対温度273度)で最高温度は同じだとすると、熱効率は88%になります。
そんな訳で、外気温度が30℃と0℃では僅かにエンジンの熱効率は上がりますが、実際のエンジンはもっと熱効率は悪いので、殆ど差は無いと見た方が良さそうです。
巷では寒い方がクルマのエンジン出力はアップすると言われていますが、本当でしょうか?

寒いとエンジンの出力はアップするのか?
これを、以下にありますカルノーサイクルにおける理想気体の熱効率の式から求めてみます。
カルノーサイクルにおける理想気体の熱効率=1-(最低絶対温度/最高絶対温度)
ここで最低温度を外気温度の30℃(絶対温度303度)、最高温度をエンジン内の2000℃(絶対温度2273度)とすると、熱効率は87%になります。
また最低温度を外気温度の0℃(絶対温度273度)で最高温度は同じだとすると、熱効率は88%になります。
そんな訳で、外気温度が30℃と0℃では僅かにエンジンの熱効率は上がりますが、実際のエンジンはもっと熱効率は悪いので、殆ど差は無いと見た方が良さそうです。
10. エントロピーの具体例
それでは実際にエントロピーを計算してみましょう。
熱機関では難しいので、ここでは水の3形態について計算してみます。
例えばここに0℃ (絶対温度273K) の氷が1gあるとして→それが溶けて0℃の水になり→次に100℃ (絶対温度373K) のお湯になり→最後に100℃の蒸気になる場合のエントロピーを計算してみます。

①0℃の氷⇒0℃の水のエントロピー
氷の融解熱を334 J/gとすると、以下の様になります。
S=∫dQ/T
=∫(273→273) (dQ/T)=1/273x∫(273→273) (dQ)=1/273x334=1.22 J/K
②0℃の水⇒100℃の水のエントロピー
水の比熱を4.2 J/gとすると、以下の様になります。
S=∫dQ/T
=∫(273→373) (dQ/T)=∫(273→373) (4.2/T)dT=4.2x In(373/273)=1.31 J/K
③100℃の水⇒100℃の蒸気のエントロピー
水の気化熱を2256 J/gとすると、以下の様になります。
S=∫dQ/T
=∫(373→373) (dQ/T)=1/373x∫(373→373) (dQ)=1/373x2256=6.05 J/K
11. 考察
前述の太字がそれぞれのエントロピーですが、高い順に並べると以下の様になります。
③お湯⇒蒸気(6.05 J/K) > ②水⇒お湯(1.31 J/K) > ①氷⇒水( 1.22 J/K)
これを見て皆さんはどう思われるでしょうか?
この数値が高い程、不可逆性が高い、すなわち元に戻り難いのです。
例えば、氷から水になるより、お湯から蒸気なる方が5倍元に戻り難いのです。
そう聞けば、”あーなるほどねー”、と思われますでしょうか?
実感としては、”だからどうした”、という感じではないでしょうか?
実は筆者も同じです。
こと日常生活においてはエントロピーが分かった所で、何のメリットも感じないのです。
ちなみに各変化で水が受け取った熱量は、①が334 J、②が420 J、③が2256 Jで、熱量の多い順にエントロピーも高くなっています。
これは、S=∫dQ/Tですので、分子のQ(熱量)が大きくなればエントロピーも大きくなるので、当然の結果とも言えます。
また温度が高くなれば、エントロピーは低くなるのですが、この例ではその効果はあまり見られません。
12. 結論
という訳で、ここまで読んで頂いた方には誠に申し訳ありませんが、本書の結論は以下の通りです。
熱力学におけるエントロピーは、日常生活には全く役立たない。
恐らく、世界中のエントロピーに関する記事を読んでも、そう書かれているものは一切ないでしょう。
ですが、これが真実なのです。
もちろん不可逆性の度合いを数値で求められる事に気づいた事は自体は画期的な事で、それを否定するものではありませんが、余程の事がない限りエントロピーの数値だけを利用する事はないだろうというのが本書の結論です。
なぜならば、現実的に必要なのは仕事量や熱効率であり、その中にはQ/Tの式は至る所に入っており、何もエントロピーを意識しなくても、それらは求められるのですから。
実際エントロピーに関する文献は図書館に行けば山の様にあるのですが、どの文献にもエントロピーを知れば実生活のこんな事に応用できるという記述は一切ありません。
だったら何が書かれているかと言えば、150年前に欧州で発行された論文の式をそのまま貼り付けて、それに分かり難い解説と例題問題と挿絵を追加しているだけなのです。
多少言い過ぎかもしれませんが、エントロピーの現実的な用途は大学での熱力学の試験問題だけしかありません。
おまけに前記しました様に、それを計算して求めてもただただ増えるだけの値なので、大小を比較しても殆ど何の意味もありません。
繰り返しますが、エントロピーを知っても実生活において何の役にも立ちません。
13. まとめ
さて、予想外の結論をお伝えしたのですが、本書がお伝えしたかった事は、実はもう一つ別にあります。
エントロピーの概念を体系化したのはドイツの物理学者クラウジウスなのですが、その後ボルツマンによってエントロピーが気体分子の動きを統計的に解析する事で説明できる事を突きとめます。
このため、昨今エントロピーという単語を使って、安易に乱雑さ、複雑さ、混沌、不確実性、均一性を表す風潮があります。
実際、統計や情報工学の分野でも使われていますが、それらは本来のエントロピーと整合を取ったり、新たな定義を確立して使っているのです。
ですので、”この部屋はちらかっているので、エントロピーが高い”、と言うと格好は良いのですが、極めて観念的な部屋の見た目の乱雑さと数値で表現できるエントロピーとは天と地ほどに差があるのです。
ましてや前述の例文の様に、エントロピーとゴミを同意語として扱うのはもってのほかです。
ゴミならゴミと、正確に言えば良いだけの話です。
また、はじめにに載せた下の絵も、エントロピーの説明ではなく単なる乱雑さの説明図でしかありません。
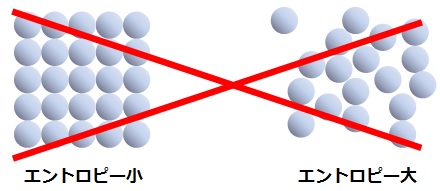
エントロピーを全く理解しないで描かれたエントロピーの概念図
良い子は、決して真似をしてはいけません。
というのをどうしても言いたくて本書を作成しましたが、少しはお役に立ちましたでしょうか?
小学生でも分かるエントロピーの話