塩素と塩酸の違い
2020/04: 発行
はじめに
恐らく大多数の方は、塩素と塩酸は似たものだと思われているのではないでしょうか。
確かにどちらも危険なので、似ていると言えば似ているのですが、両者は当然ながら異なる物です。
今回はその違いを明らかにしたいと思います。
塩素
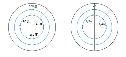
先ず塩素(Cl)ですが、これは自然界では黄緑色の気体で、下の図にあります様に一番外側の電子が1個足りない電子配置になっています。
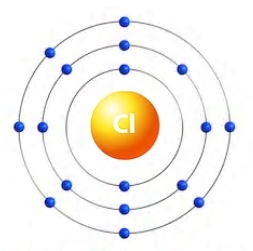
外側の電子が1個足りない塩素(Cl)の電子配置
これが何を意味するかと言えば、この様な元素は自然界で非常に不安定な状態にあり、事あらば他の元素から電子を奪って(正確には共有して)結合しようとするのです。
そう聞いただけで、いかにこの塩素ガスが怖いか分かって頂けるのではないでしょうか。
混ぜてはいけないと言われる、塩素系洗浄剤と酸性タイプ洗浄剤をうっかり混ぜてしまうと、この怖い塩素ガスが発生する事になるのです。
余談ですが、昔高校で習った元素周期表の右から2番目にある塩素(Cl)達(フッ素、ボロン等)がこの電子が1個なくて不安定な元素で、これらをハロゲン族元素と呼びます。

また周期表の一番左にある元素は電子が1個多い元素で、その代表格のナトリウム(Na)が塩素(Cl)と結合したのが塩化ナトリウム(NaCl)、すなわち食塩になります。
危険な元素二つが結合すると、安定化すると共に人体に有益な物質に変わるのですから、自然界のメカニズムに感動すると共に、周期表をここまで埋めた化学者の皆さんに頭が下がります。
塩酸
次は塩酸です。
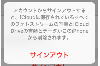
塩酸とは、無色透明で刺激臭のある気体である塩化水素(HCl)を水に溶かした物です。
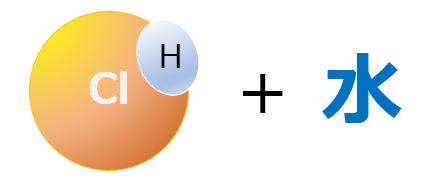
塩化水素(HCl)を水に溶かした物が塩酸
このHClを水に溶かすと、H+とCL-に分かれます。

HClを水に溶かすとH+とCL-に分かれる
化学の世界では、このH+が沢山あるのを酸性と呼びますので、塩酸は強い酸性という事になります。
そしてこの沢山あるH+とCL-が何をするかと言えば、金属をも溶かしてしまうのです。

ですので、酸性タイプのトイレ用洗浄剤は便器に固着したカルシウムやマグネシウム等を除去するのに最適という訳です。
また万一人体に付着した場合は、タンパク質を変成させて化学やけどを引き起こす事になります。
その場合ですが、(塩素系洗浄剤も同じですが)急いで水で洗い流す事が重要です。
まとめ
まとめです。
①塩素とは黄緑色の気体であり、外側の軌道の電子が1個足りないため不安定で、他の元素と結合し易いが故に人体にとっても有害である。
②塩酸とは塩素を水に溶かした液体であり、強い酸性のため金属をも溶かす事ができ、トイレやタイルの鉱物系の汚れの洗浄に最適である。
こんな説明で、お役に立ちましたでしょうか?
塩素と塩酸の違い